Для кристаллогидратов как и для всех химических соединений существуют правила названий. Название кристаллогидрата строится из систематического названия соли и указывается количество молекул кристаллизационной воды входящих в формальную единицу. Рассмотрим конкретные примеры.
CuSO4· 5H2O – пентагидрат сульфата меди;
Na2CO3· 10H2O – декагидрат карбоната натрия;
AlCl3· 6H2O – гексагидрат хлорида алюминия.
Следует отметить, что содержание воды в кристаллогидратах формально может иметь и нецелочисленное значение, поэтому в таких случаях поступают следующим образом: CdSO4 · 2,67 H2O – 2,67- гидрат сульфата кадмия, SO2 ·n H2O – полигидрат диоксида серы. Однако рассмотренный способ названия кристаллогидратов довольно упрощенный. Если нам известна структура образуемого соединения, то мы можем его назвать более конкретно, при этом указав в какой форме вода находится в данном соединении и с какими ионами она связанна. Исследование строения кристаллов CuSO4· 5H2O показало, что в его формульной единице четыре молекулы воды связаны с атомом меди, а пятая – с сульфатными ионами. Таким образом, формула этого вещества – [Cu(H2O)4]SO4· H2O, имеет называние моногидрат сульфата тетрааквамеди (II).
Аналогичное строение имеет соединение [Fe(H2O)6]SO4· H2O – моногидрат сульфата гексаакважелеза(II).
Однако часто нам не нужно применять систематическую номенклатуру, а можно воспользоваться тривиальными названиями веществ. Так CuSO4 · 5H2O – медный купорос, Na2CO3· 10H2O – «кристаллическая» сода и т.д. [2], [26].
Классификация
Классификацию кристаллогидратов можно вести по различным критериям:
1. По наличию связи структуры безводного вещества и кристаллогидрата
· фазы определенного состава – вид кристаллогидратов, у которых при удалении кристаллизационной воды происходит сжатие кристаллической решетки, поэтому структура безводного вещества и кристаллогидрата не связанны между собой. К данному классу относятся кристаллогидраты многоосновных кислот, оснований и клатратов.
· неопределенного состава – вид кристаллогидратов, у которых процесс удаления воды может быть осуществлен без существенных изменений в кристалле. Это возможно при наличии в кристалле достаточного количества свободных промежутков, каналов (чтобы уместились молекулы воды). У веществ этого класса может происходить обратимая гидратация и дегидратация. Примерами таких веществ являются цеолиты [32].
2. По количеству молекул воды входящих в формульную единицу кристаллогидрата
· Существует кристаллогидраты, в которых на одну молекулу или частицу гидратированного вещества приходится 1,2,3,4,5,6,7,8,9,10,12 молекул воды.
· Но наиболее распространенными являются кристаллогидраты с 1,2,4,6,8 молекулами воды.
· Для многих веществ известны кристаллогидраты различного состава.
3. По природе соединения участвующего в образовании кристаллогидратов
3. По агрегатному состоянию гидратообразователя при н.у.
Жидкость (серная кислота, этиловый спирт)
5. Класс соединений
6. Температурная устойчивость
· Если кристаллизационная вода удерживается Ван-дер-Ваальсовыми силами, то такие вещества стабильны при температурах ниже нуля (клатраты)
· Если кристаллизационная вода удерживается в кристаллогидрате слабыми межмолекулярными связями, то она легко удаляется при нагревании:
· Если же в кристаллогидрате связи между молекулами воды и другими частицами близки к химическим, то такой кристаллогидрат или дегидратируется (теряет воду) при более высокой температуре, например:
или при нагревании разлагается с образованием других химических веществ, например:
7. По состоянию воды в гидратах
· Псевдогидраты – это соединения, в которых часть молекул кристаллизационной воды образуют гидроксид ионы или ионы гидроксония (HClO4·H2O = H3O·ClO4 , Sr(BO2)2·4H2O = Sr[B(OH)4]2) Воду, входящую в состав псевдогидратов называют конституционной [39].
молекулы воды изолированы друг от друга. Атомы кислорода в воде координируются вокруг центрального иона: CuCl
Внутрисферные кристаллогидраты – молекулы кристаллизационной воды удерживаются благодаря ковалентной
Смешанные кристаллогидраты – кристаллизационная вода удерживается за счет образования водородных связей
и донорноакцепторного взаимодействия. К данной группе можно отнести купоросы (CuSO4·5H2O или [Cu(H2O)4]SO4·H2O), пятая молекула воды связывается именно водородными связями (Приложение2, Рис 2) [2].
молекулы воды образуют цепи. В ряде случаев молекулы воды связывают два катиона
Zn(OH)H2O и BaCl2• H2O. Образуются бесконечные цепи.
Молекулы воды образует слои, объединяемые ионами соли (
Своеобразными упорядоченными твердыми растворами внедрения типа соль — лед являются некоторые кристаллогидраты с большим числом молекул воды, например
Na2SO4·10Н2О, Na2СO3·10Н2О (тектогидраты). Они имеют структуру льда, которая стабилизируется за счет стягивающего действия электростатически взаимодействующих ионов противоположного знака. Вследствие этого температура плавления тектогидратов намного превышает температуру плавления льда [2].
Значение кристаллогидратов
Образование и разрушение газовых клатратов используются, для разделения газов опреснения морской воды. Клатраты в природе часто играют роль естественного хранилища газов. Кристаллогидраты занимают важное место в строительстве в процессах схватывания и твердения вяжущих. В растительных клетках часто встречаются кристаллы оксалата кальция. Кристаллы представлены в основном моно(CaC2O4•H2O) и дигидратами (CaC2O4•2H2O). Первые кристаллизуются в клиноромбической системе, вторые в гексагональной. Они откладываются только в вакуолях. Форма кристаллов оксалата кальция довольно разнообразна и часто специфична для определенных групп растений. Это могут быть одиночные кристаллы ромбоэдрической, октаэдрической или удлиненной формы (клетки наружных отмерших чешуи луковиц лука), друзы (чешек, druza — группа) — шаровидные образования, состоящие из многих мелких сросшихся кристаллов (клетки корневищ, коры, корки, черешков и эпидермы листьев многих растений), рафиды (греч. рафис — швейная игла) — мелкие игольчатые кристаллы, соединенные в пучки (стебель и листья винограда), и кристаллический песок — скопления множества мелких одиночных кристаллов (паренхимные клетки многих пасленовых бузины). Наиболее часто встречающаяся форма кристаллов — друзы.
Выводы: с момента первоначального изучения кристаллогидратов до настоящего времени в науке накопилось большое количество сведений о таком классе химических соединений, как кристаллогидраты. Школьное химическое образование не должно отставать от достижений, происходящих в научном мире, поэтому целью данной главы является проведение анализа химической литературы и выяснение того, как рассматривается тема кристаллогидраты на современном этапе развития химии. Анализ показал, что по данной теме появилось достаточно много новой информации. Данная тема имеет очень важное значение, как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы.
Общие положения
Растворы занимают промежуточное место между химическими соединениями и механическими смесями. Однородность растворов делает их схожими с химическими соединениями, также на химическое взаимодействие между компонентами растворов указывает выделение теплоты при растворении некоторых веществ.
Еще одним доказательством того, что компоненты раствора химически взаимодействуют друг с другом, служит тот факт, что многие вещества выделяются из водных растворов в виде кристаллов, содержащих кристаллизованную воду – гидратов; причем на каждую молекулу растворенного вещества приходится определенное число молекул воды. Как правило, гидраты – нестойкие соединения, во многих случаях они разлагаются уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в состав которых входят молекулы воды называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной. Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизованной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата натрия, содержащий на один моль сульфата натрия десять молей воды выражается формулой 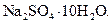
В нашей жизни получили широкое распространение тривиальные названия веществ. В таблице 1 приведены наиболее часто встречающиеся формулы кристаллогидратов, их тривиальные названия и названия по систематической номенклатуре, рекомендованной ИЮПАК.
Самые известные кристаллогидраты
| Кристаллогидрат | Тривиальное название | Название по систематической номенклатуре |
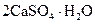 |
Алебастр, жженый гипс | Гидрат сульфата кальция |
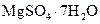 |
Английская соль, горькая соль | Гептагидрат сульфата магния |
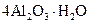 |
Алюмогель | Гидрат оксида алюминия |
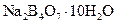 |
Бура | Декагидрат тетрабората натрия |
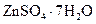 |
Белый купорос, цинковый купорос | Гептагидрат сульфата цинка |
| Кристаллогидрат | Тривиальное название | Название по систематической номенклатуре |
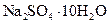 |
Глауберова соль | Декагидрат сульфата натрия |
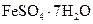 |
Железный купорос, зеленый купорос | Гептагидрат сульфата железа (II) |
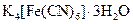 |
Желтая кровяная соль | Тригидрат гексацианоферрата (II) калия |
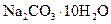 |
Кристаллическая сода | Декагидрат карбоната натрия |
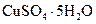 |
Медный купорос, синий купорос, синий камень | Пентагидрат сульфата меди (II) |
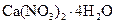 |
Норвежская селитра | Тетрагидрат нитрата кальция |
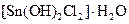 |
Оловянная соль | Гидрат дихлородиакваолова (II) |
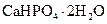 |
Преципитат | Дигидрат гидрофосфата кальция |
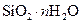 |
Силикагель | Полигидрат оксида кремния |
Растворы отличаются от химических соединений тем, что состав взаимодействующих веществ может изменяться в широких пределах. В свойствах раствора можно обнаружить многие свойства компонентов его составляющих, что характерно для механических соединений.
Исходя из всего вышесказанного, можно дать следующее определение раствора.
Раствор – однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия, относительные количества которых могут изменяться в широких пределах.
Существует несколько способов классификации растворов.
I. По агрегатному состоянию:
1. Жидкие (морская вода)
2. Газообразные (воздух)
3. Твёрдые (многие сплавы металлов)
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие однородные смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
II. По размеру частиц растворенного вещества:
1. Истинные (размер частиц менее 1·10 −9 м)
Растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
2. Коллоидные (размер частиц 1·10 −9 м — 5·10 −7 м)
Частицы в таких растворах можно обнаружить при помощи ультрамикроскопа
III. С точки зрения термодинамики:
Внутренняя энергия каждого компонента не зависит от концентрации. Компоненты раствора смешиваются, как идеальные газы; предполагается, что сил взаимодействия между частицами нет, и вещества смешиваются без выделения или поглощения теплоты.
2. Неидеальный (реальный) Растворы, не удовлетворяющие условиям идеальных растворов, относят к реальным. Чем меньше концентрация раствора, тем ближе он к идеальному раствору.
IV. По величине электрической проводимости:
1.Электролитический (проводит электрический ток)
2. Неэлектролитический (электрический ток не проводит)
V. По количеству растворенного в нем вещества:
1. Насыщенный раствор – раствор, который находится в динамическом равновесии с избытком растворённого вещества, то есть молекулярные или ионные частицы, распределённые в жидком растворе, присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества. Насыщенный раствор является стабильной системой, т.е. может существовать при данной температуре без изменения сколько угодно долго.
Пример: если поместить 50 г NaCl в 100 г H2O, то при 20 ºC растворится только 36 г соли.
2. Ненасыщенный раствор – раствор, содержащий меньше вещества, чем необходимо для насыщения.
Пример: если поместить в 100 г воды при 20 ºC менее 36 г NaCl.
3. Перенасыщенный раствор – раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Пример: При нагревании смеси соли с водой до 100 ○ C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20 ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Такие растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Любой раствор состоит из растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем обычно считается жидкость, а растворенным веществом – растворенный газ или твердое вещество, независимо от их относительного количественного содержания. Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Если компоненты обладают неограниченной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов растворителем считается вещество, присутствующее в относительно большем количестве. Понятия растворитель и растворенное вещество теряют смысл, когда речь идет о смесях с примерно равными или близкими концентрациями компонентов.
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями.
Концентрацией раствора называют содержание растворенного вещества в единице объема или массы раствора или растворителя. Растворы, содержащие растворенное вещество в количестве, соизмеримом с количеством растворителя, называют концентрированными. Растворы с малой концентрацией растворенного вещества, называют разбавленными. Граница между концентрированными и разбавленными растворами условна.
В химии используют более десятка способов выражения концентрации. Ниже в таблице 2 приведены наиболее часто употребляемые на практике способы выражения содержания растворенного вещества в растворе.
Дата добавления: 2015-08-12 ; просмотров: 9077 . Нарушение авторских прав
Растворы.
Растворы – это однородные смеси, содержащие не менее двух веществ.
По агрегатному состоянию различают растворы твердые, газообразные и жидкие.
Наиболее распространены жидкие растворы.
Сходства растворов с химическими соединениями:
– растворы однородны и устойчивы, не осаждаются и не расслаиваются при длительном стоянии;
– процесс растворения сопровождается тепловым эффектом.
Сходства растворов со смесями:
– растворы не имеют постоянного состава, он может изменяться в широких пределах;
– растворы сохраняют многие свойства растворителя и растворенного вещества. Они могут быть легко разделены на составные части, как и смеси.
Растворы занимают промежуточное положение между смесями и химическими соединениями.
Гидраты.
Гидраты – это нестойкие соединения, которые образуются при химическом взаимодействии молекул воды с частицами растворенного вещества.
Процесс образования гидратов называют гидратацией.
Гидраты, как правило, разлагаются при выпаривании растворов.
Кристаллогидраты.
Кристаллогидраты – это кристаллические вещества, содержащие молекулы воды.
Воду, входящую в состав кристаллогидратов, называют кристаллизационной.
Формулы кристаллогидратов.
Кристаллогидрат сульфата меди(II) (медный купорос): CuSO4 • 5H2O.
Железный купорос: FeSO4 • 7H2O.
